
一种HA药物纳米颗粒,用于乳腺癌治疗。
Introduction
思路:
- 乳腺癌是美国女性癌症死亡的第二大原因。尽管常规化疗已成为转移性乳腺癌的标准治疗方法,但由于癌细胞耐药性,单药治疗仍无法治愈该疾病。而不同分子机制化疗药物联合用药能显示出更大的疗效。因此,需要寻求增强癌症治疗效果和患者存活率的联合用药新策略。
- 基于化学免疫调节剂的免疫疗法可以利用身体的免疫系统来对抗癌症并延长患者的总体生存期。其中,咪喹莫特(imiquimod,IMQ)是一种抗肿瘤和抗病毒免疫调节剂,通过与细胞表面受体如Toll样受体7(Toll-like receptor 7)结合,从而诱导促炎细胞因子如干扰素α(IFN-α)、肿瘤坏死因子α(TNF-α)和白细胞介素12(IL-12),导致抗原呈递细胞与其他先天免疫因子一起激活,最终产生T细胞介导的抗肿瘤免疫反应。临床结果也表明,IMQ作为抗癌免疫治疗的佐剂具有很大的前景。
- 化疗药物还可以直接或间接诱导各种肿瘤细胞死亡方式,并可能释放肿瘤相关抗原,触发免疫细胞激活抗肿瘤免疫。
- 本研究中,作者将化疗药物(GEM)和免疫调节药物(IMQ)与透明质酸(HA)结合,以开发HA药物纳米颗粒。与小分子药物通过扩散进入细胞不同,纳米颗粒通常通过受体介导的内吞作用将药物输送到癌细胞中。作者证明了化疗药物和免疫调节药物的同时递送在体外和体内都对抑制肿瘤细胞产生了有效的反应。重要的是,这些研究强调了IMQ在调节肿瘤部位免疫细胞中的作用。
常用的化疗方案包括:
- 抗代谢药物:吉西他滨(gemcitabine)、氟尿嘧啶(fluorouracil);
- 蒽环类药物:多柔比星(doxorubicin)、表柔比星(epirubicin);
- 微管靶向药物:紫杉醇(paclitaxel)、多西他赛(docetaxel);
- 烷化剂:环磷酰胺(cyclophosphamide)、苯丁酸氮芥(chlorambucil);
- 铂类药物:顺铂(cisplatin)、卡铂(carboplatin)。
Synthesis and characterization of HA-drug conjugates
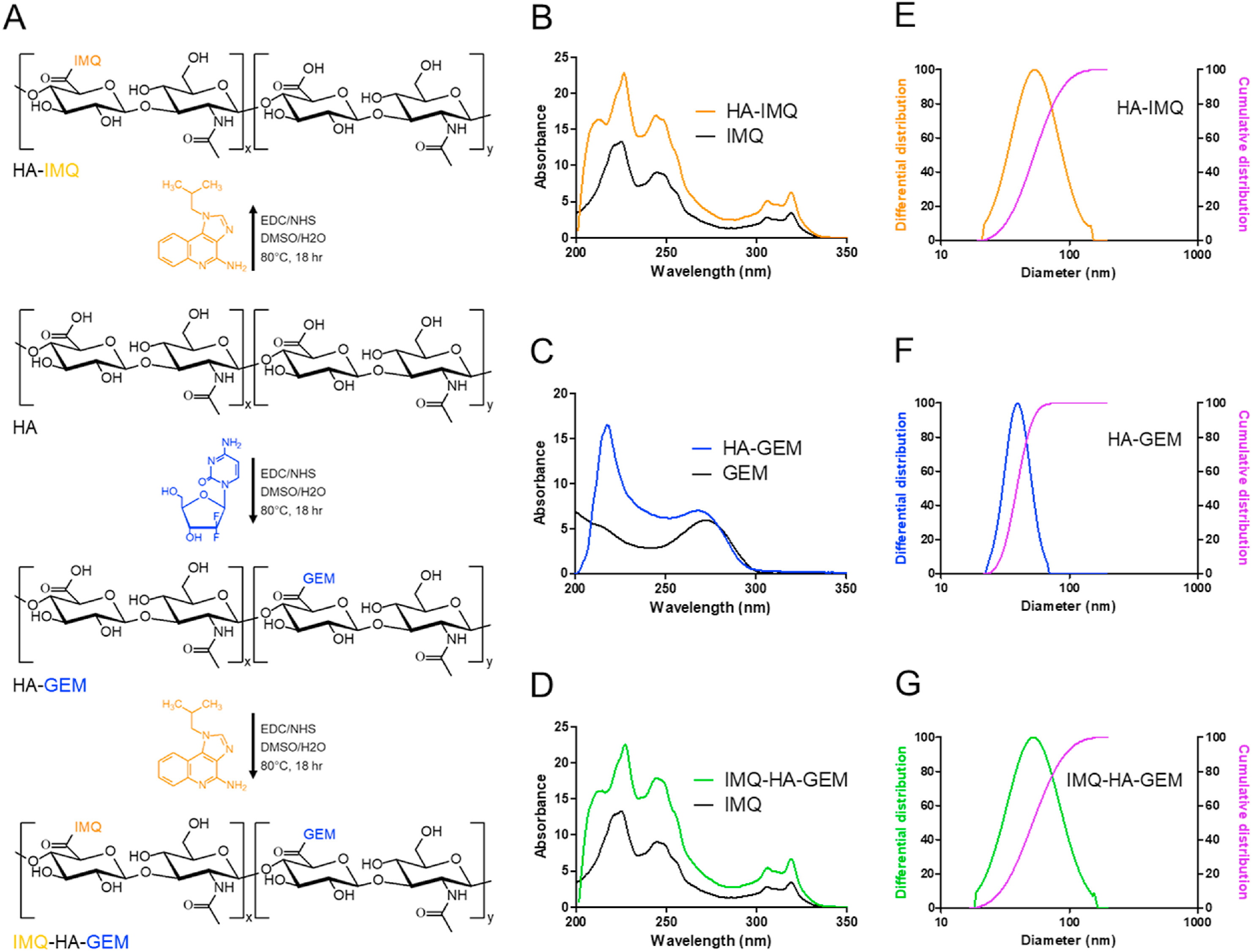
HA是一种天然聚合物,包含两个不同的糖单元,其主链上有多个官能团以结合药物。
- (A)使用EDC/NHS化学在HA骨架中缀合IMQ和GEM的反应方案。HA的羧酸基团首先被活化,并进一步与IMQ或GEM的伯胺反应,分别生成HA-IMQ或HA-GEM。以类似的方式,HA-GEM被激活并与IMQ反应生成IMQ-HA-GEM。
- (B-D)HA-药物偶联物的紫外-可见吸收光谱,在245 nm处测量IMQ和265 nm处测量GEM,以显示药物偶联到HA。(D)图没有GEM峰是由于IMQ包含几个π键,可能会掩盖或重叠GEM的峰。
- (E-G)通过动态光散射仪(DLS)测量的水中HA药物缀合物的粒度(差异和累积)分布。
Cellular uptake and Cytotoxic effects of HA-drug nanoparticles in vitro
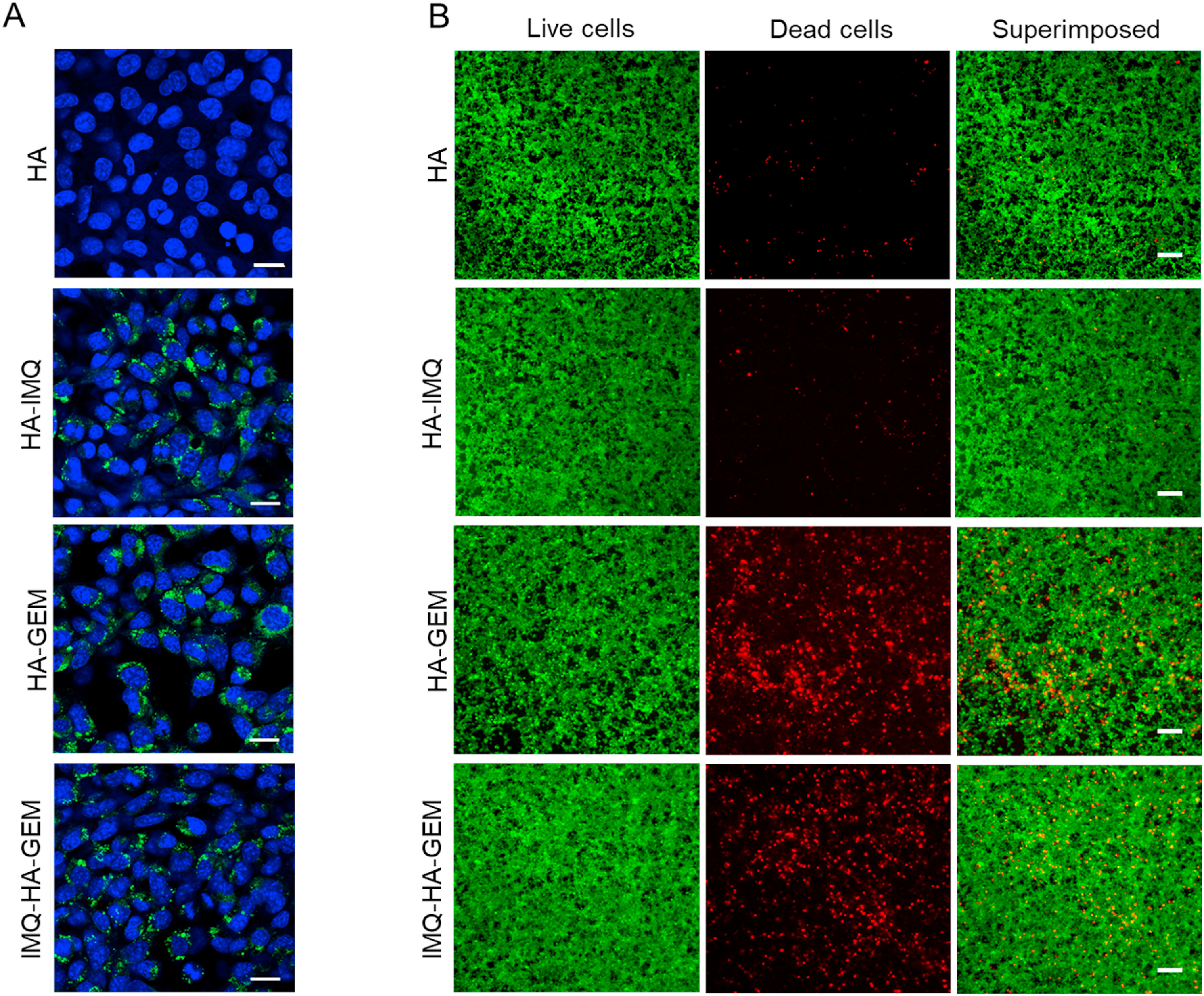
(A)4T1细胞与未标记的HA或FITC标记的HA药物纳米颗粒(绿色)孵育2 h的共聚焦荧光显微图像,细胞核用DAPI(蓝色)染色。结果表明HA药物纳米颗粒在细胞内的内化。
(B)用不同HA药物纳米粒子(5 μM)处理24 h后4T1细胞的活(绿色)/死(红色)染色的荧光图像。IMQ-HA-GEM和HA-GEM纳米颗粒对4T1细胞具有明显的细胞毒性。
4T1细胞:小鼠转移性乳腺癌细胞;
THP-1细胞:人源单核细胞。
Infiltration study of circulating THP-1 cells using high-content in vitro breast cancer model
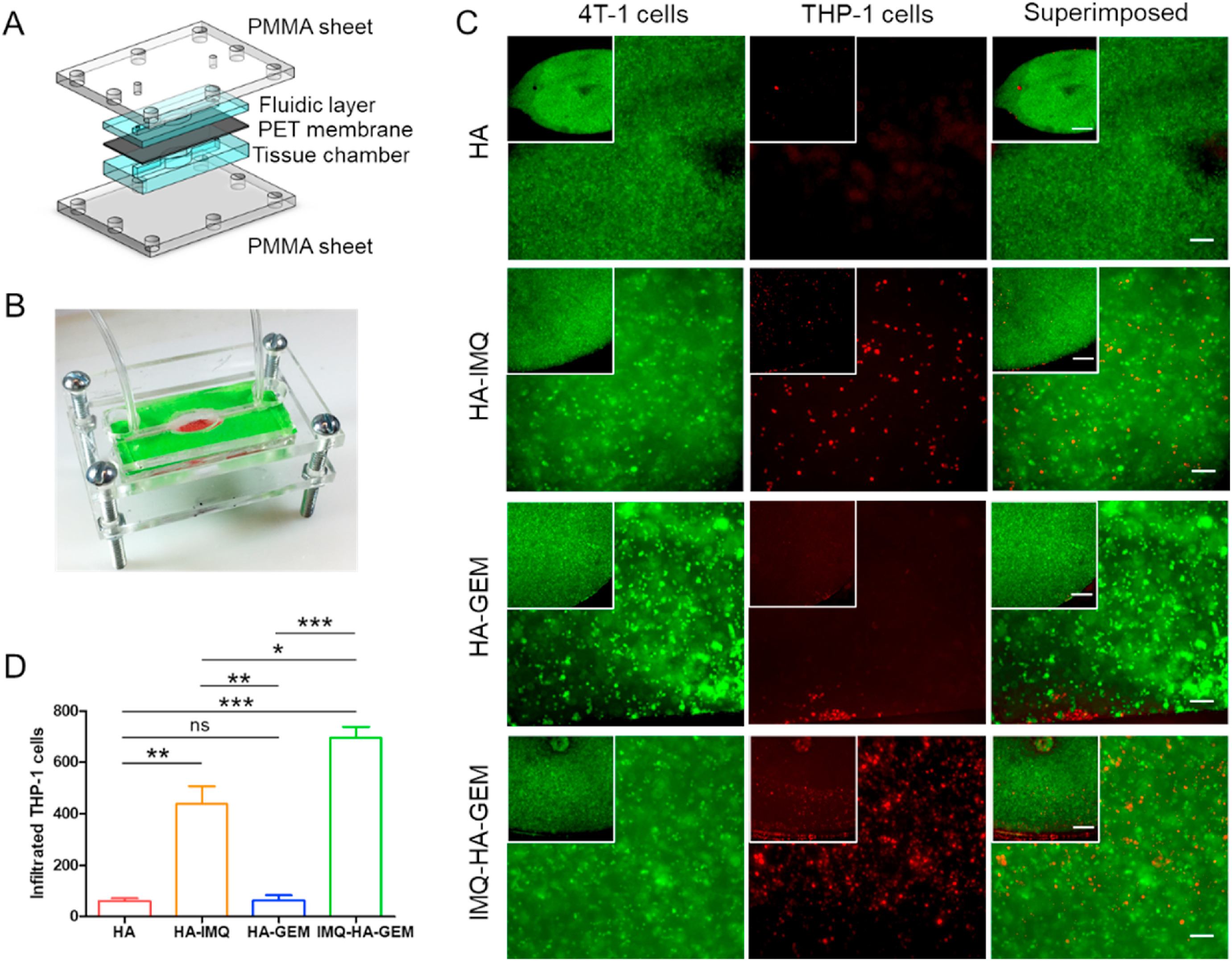
- (A)3D分区乳腺癌芯片(BCC)装置示意图。由底部乳腺癌组织室(装有绿色CMFDA标记的4T1细胞的GelMA水凝胶)、中部PET膜屏障和上部流体通道组成,该通道具有用于培养基和/或CM Dil标记的THP-1细胞循环的入口和出口。
- (B)组装好的BCC装置照片。
- (C)4T1细胞(绿色)在乳腺癌组织室中培养并从顶部血管室渗入同一室中的THP-1细胞(红色)的荧光图像。在循环THP-1细胞(5×105 cells)之前,用HA药物纳米粒子(5 μM)处理每个具有4T1(2×105 cells)的组织室 4 h。在HA-GEM处理下,仅发现少数THP-1细胞迁移到乳腺癌组织室中。相反,在用HA-IMQ或IMQ-HA-GEM处理BCC后THP-1细胞循环时,大量的THP-1细胞迁移到乳腺癌组织室内。
- (D)ImageJ量化乳腺癌组织室中浸润的THP-1细胞的数量。结果表明,含有IMQ的HA药物纳米粒子在将THP-1细胞吸引到乳腺癌组织室中起关键作用。
Antitumor effects of HA drug nanoparticles in vivo
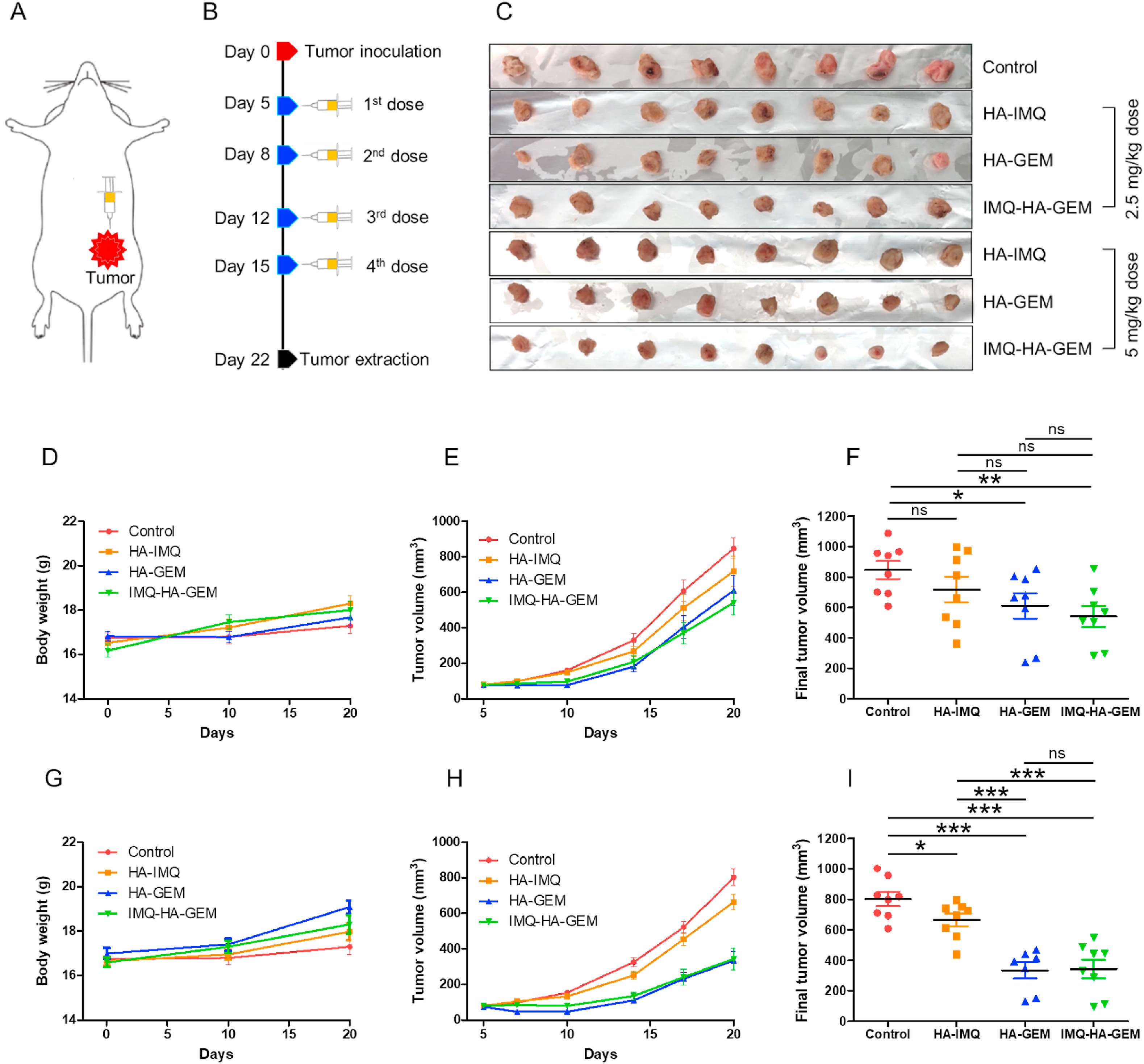
- (A)4T1肿瘤小鼠皮下注射治疗方案。
- (B)药物注射时间表的示意图。每隔3~4 d将HA药物纳米颗粒皮下注射(2.5或5 mg/kg)到小鼠的肿瘤部位,共注射4次。
- (C)在第22 d从每个治疗组中提取每只小鼠的肿瘤图像。根据GEM浓度2.5 mg/kg(D,E,F)或5 mg/kg(G,H,I)给药。
- (D,G)不同组中4T1肿瘤小鼠的体重变化。对照小鼠的平均体重在肿瘤接种后3 w内仅增长3.3%,表明小鼠的正常生长受到肿瘤发展的阻碍。在低剂量给药时,用HA-GEM治疗的小鼠体重平均增加了5.1%。在高剂量给药时,用HA-GEM处理的小鼠的体重平均增加了12.3%。
- (E,H)不同组中4T1肿瘤的生长动力学。对照小鼠原位乳腺肿瘤随时间呈指数增长。
- (F,I)治疗后最终4T1肿瘤体积的评估。治疗组明显小于对照组,且高剂量给药体积相对更小。
Immune response of HA drug nanoparticles in vivo
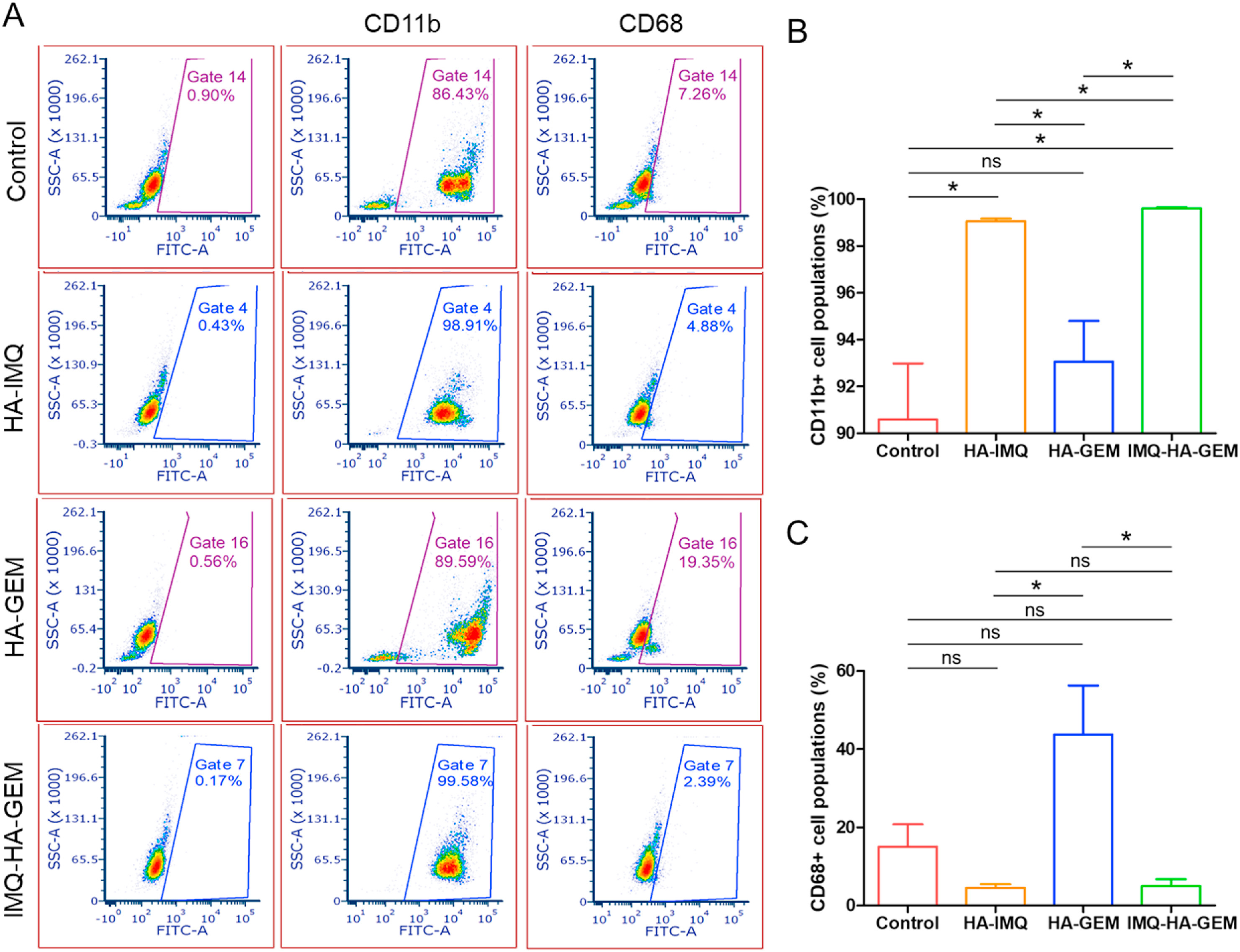
- (A)流式细胞仪门控数据显示阳性细胞的百分比。小鼠处死后立即收集血液,与抗CD11b和抗CD68抗体一起孵育,并通过流式细胞术进行分析。
- (B)血液中CD11b+细胞群的分析。CD11b在功能上与白细胞抑制、迁移和粘附有关。结果显示,与对照组相比,HA-IMQ处理的小鼠和IMQ-HA-GEM处理的小鼠的血液CD11b+细胞群显著更高,且IMQ-HA-GEM处理的小鼠血液中的免疫细胞群显著更高,表明了IMQ在体内激活免疫细胞中的作用。
- (C)血液中CD68+细胞群的分析。CD68为巨噬细胞、单核细胞标志物。结果显示,用HA-IMQ或IMQ-HA-GEM治疗的小鼠在血液循环中显示出低数量的CD68+细胞群(尤其是单核细胞/巨噬细胞),表明巨噬细胞从血液浸润到身体其他部位的可能性更高,特别是在肿瘤部位。
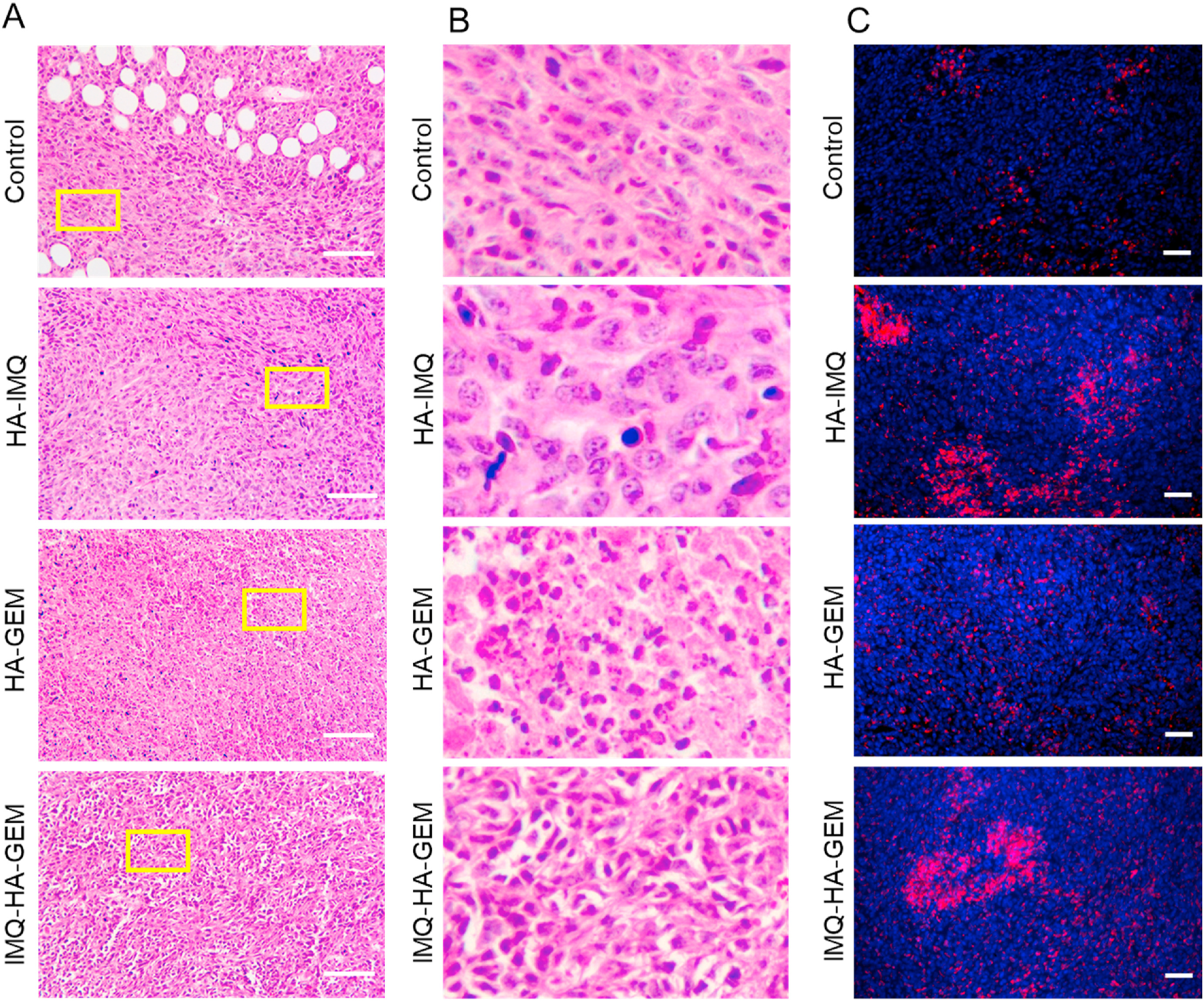
- (A)肿瘤切片的HE染色。
- (B)使用Aperio ImageScope放大(60%)的HE染色肿瘤切片的图像(A中相应图像的插图)。HA-GEM处理的肿瘤的组织切片具有广泛的纤维化样状况(高毒性),可能是由于吉西他滨活性破坏细胞导致肿瘤生长受到抑制而发生的。相反,IMQ-HA-GEM处理组的组织切片显示出轻微的纤维化状态(低毒性,细胞均一,形状和大小变化不大)。
- (C)使用CD68 rabbit mAb(红色)和DAPI(蓝色)对肿瘤切片进行免疫组织化学染色。观察到在肿瘤切片中未经药物治疗的浸润巨噬细胞数量很少。而在HA-IMQ和IMQ-HA-GEM处理的的小鼠的肿瘤中观察到许多肿瘤浸润性巨噬细胞,在IMQ-HA-GEM处理的组织室中浸润的THP-1单核细胞数量更多。
Discussion
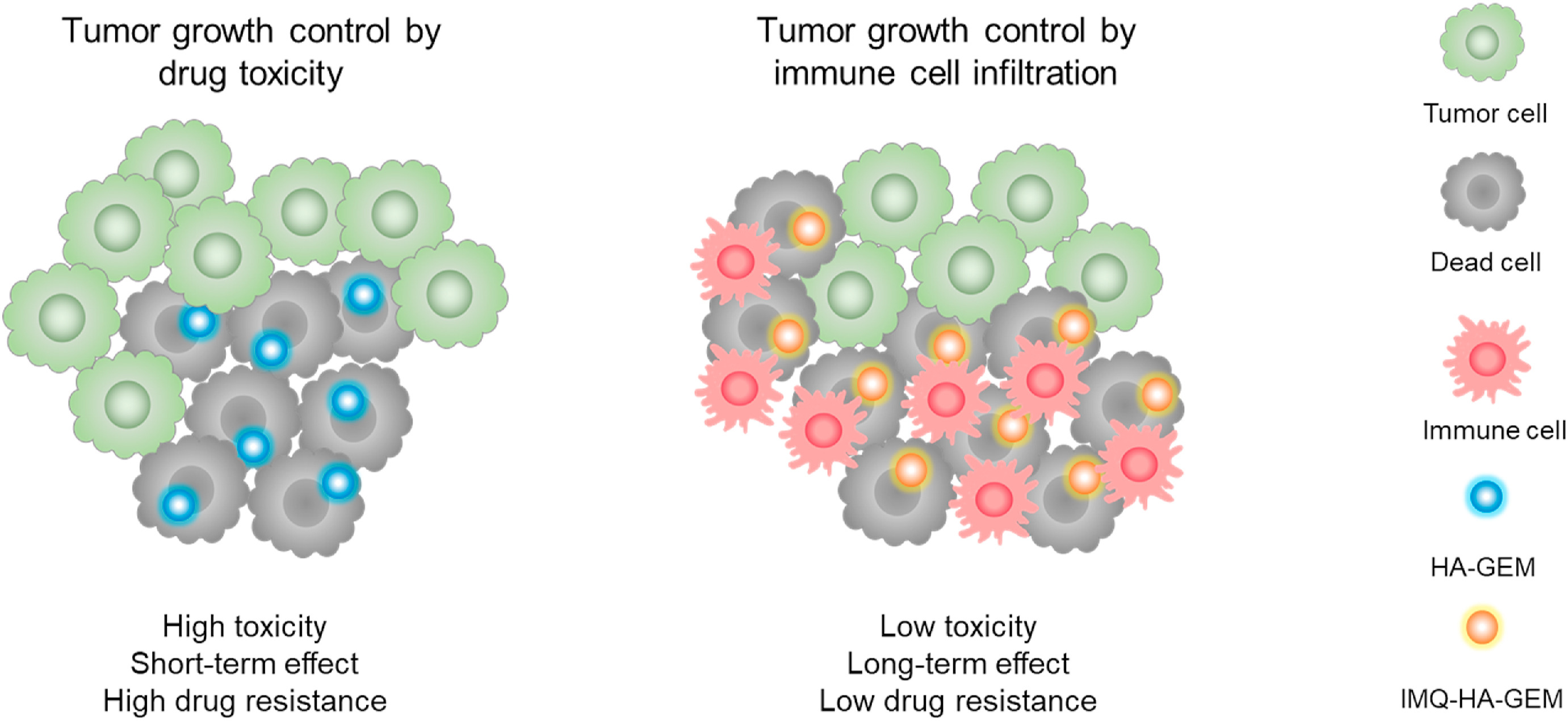
通过联合用药对癌症进行化学免疫治疗的示意图。将免疫治疗剂与药物化疗方案相结合可以触发强大且持续的抗肿瘤免疫。
- 目前使用抗体的乳腺癌免疫疗法(如派姆单抗)会引起许多与免疫相关的不良反应,而单独的化疗不会引发这些不利影响。
- 推进当前免疫疗法的复杂性及其异常高的癌症治疗成本,使用现有化疗药物开发新的乳腺癌治疗方法变得更加重要。作者的研究策略是在免疫调节药物(IMQ)的帮助下开发一种更安全的疗法,以提高化疗药物(GEM)治疗乳腺癌的有效性,这是第一项使用GEM和IMQ的组合进行癌症治疗的研究。
- 载体选择了HA聚合物,当其与小分子药物结合时,它们会自组装形成纳米颗粒,且HA具有生物相容性、生物降解性和非免疫原性等特性。此外,HA对CD44受体表现出很强的亲和力,CD44受体在包括4T1在内的各种乳腺癌细胞中高度表达,因此可以加速CD44受体介导的HA偶联药物在4T1细胞中的内化 。
- 器官芯片可以以更准确的方式评估纳米药物。因此设计了一个3D分隔的微流控BCC系统。发现仅当用HA-IMQ或IMQ-HA-GEM处理时,THP-1细胞在4T1肿瘤组织隔室中的积累明显更高。基于这些观察,假设IMQ-HA-GEM在3D组织支架内分解癌细胞并原位产生肿瘤相关抗原。这样产生的抗原,在免疫佐剂IMQ存在下,诱导免疫细胞浸润。
- 给药途径在药物的体内生物分布中起关键作用。例如,通过静脉注射给药的聚合物纳米颗粒主要积聚在肝脏和脾脏中,而通过皮下注射给药的这些纳米颗粒主要存在于局部淋巴结中。因此,皮下给药途径有利于纳米颗粒在全身循环之前进入淋巴系统,这可能有利于增强免疫治疗作用。
- IMQ可以通过半胱天冬酶激活诱导更高浓度的肿瘤细胞凋亡。当由含有纳米颗粒的GEM提供治疗时,HA-GEM和IMQ-HA-GEM即使在低剂量治疗下,也能显著减少肿瘤体积。此外,在第三剂给药之前,HA-GEM在低剂量和高剂量下的效果都比IMQ-HA-GEM更明显,这种IMQ-HA-GEM的迟发效应可能是由于IMQ在体内温和缓慢地激活免疫细胞以触发肿瘤消除。 IMQ的温和作用对于临床使用非常重要,可以避免目前基于抗体的癌症免疫疗法中的潜在不良事件。
- 肿瘤浸润免疫细胞的密度可以揭示抗肿瘤免疫状态。与HA-GEM不同,IMQ-HA-GEM处理在组织切片中显示出大量高密度的浸润巨噬细胞。有趣的是,HA-IMQ治疗组的肿瘤中也有大量浸润性免疫细胞。因此,肿瘤中浸润肿瘤的免疫细胞的密度并不一定反映抗肿瘤免疫活性,强调了潜在的肿瘤-免疫相互作用的复杂性。这一结果可能由于肿瘤中存在极化的肿瘤浸润巨噬细胞(如M1和M2巨噬细胞)。由于M1巨噬细胞(抗肿瘤活性)和M2巨噬细胞(抗炎活性)的相反功能,作者推断不仅浸润的数量而且浸润的质量(表型)决定了抗肿瘤免疫活性。
- 除此之外,应该识别各种肿瘤浸润淋巴细胞,如T细胞、B细胞、NK细胞及其信号分子,以了解肿瘤微环境的实际情况。
Conclusion
近来,研究者已寻求递送两种或多种化疗药物的策略以增强成功治疗肿瘤的治疗效果。然而,剂量限制性毒性是联合治疗的主要障碍。组合方法的另一个挑战是同时向肿瘤部位施用两种药物以产生有效的治疗结果。为了解决这些问题,作者开发了IMQ-HA-GEM纳米颗粒来提供标准化疗药物(GEM)以及低毒免疫调节药物(IMQ)。该药物组合在体外和体内均增强了对4T1乳腺肿瘤细胞的抗癌活性。最重要的是,作者展示了用IMQ-HA-GEM治疗时肿瘤部位的免疫细胞浸润,提供了明确的证据,即IMQ在浸润的免疫细胞的帮助下增强了GEM抑制肿瘤的活性。
总之,提出了一种纳米颗粒递送平台,该平台可用于使用不同的化疗药物与IMQ联合治疗各种形式的癌症。
Reference
Singh B, Maharjan S, Pan D C, et al. Imiquimod-gemcitabine nanoparticles harness immune cells to suppress breast cancer[J]. Biomaterials, 2022, 280: 121302.



